ต้นแบบกระบวนการใหม่ ระดับห้องปฏิบัติการ
โครงการ การเพิ่มประสิทธิภาพการผลิตตัวอ่อนโคด้วยวิธีโคลนนิ่งซ้ำโดยใช้ข้อมูลจากทรานสคริปโตม
TRL ตอนเริ่มต้น = TRL1, มีการรายงานหลักการพื้นฐาน
TRL ปิดโครงการ = TRL3, หลักการได้ถูกพิสูจน์ด้วยการทดลอง
1. คำสำคัญ:
โค, การโคลนนิ่งโดยใช้เซลล์ร่ากาย, พารามิเตอร์การเชื่อมเซลล์ การโคลนนิ่งซ้ำ บลาสโตซีส
2. ต้นแบบกระบวนการใหม่ระดับห้องปฏิบัติการที่เกิดขึ้นจากโครงการ
2.1. การทำโคลนนิ่งโดยใช้เซลล์ร่างกายเป็นเซลล์ต้นแบบ (Somatic cell nuclear transfer, SCNT)
2.1.1. วิธีการเตรียมเซลล์ต้นแบบ
การเตรียมเซลล์ไฟโบรบลาสจากหนังหูโค ทำโดยเก็บตัวอย่างใบหูโค แล้วแช่ไว้ในน้ำเกลือขณะเข้าห้องปฏิบัติการ ทำการโกนขนแล้วฆ่าเชื้อด้วยแอลกอฮอล์ 70% จากนั้นลอกผิวหนังด้านนอกและด้านในออกจากส่วนกระดูกอ่อน นำชิ้นผิวหนังที่ตัดเป็นชิ้นเล็กๆแล้ว มาวางในจานเลี้ยงเซลล์แล้วนำแผ่นกระจกสไสด์ปิดทับ จากนั้นเติมน้ำยา αMEM (Minimum Essential Medium Eagle, Alpha modification) + 10% fetal bovine serum (FBS) ที่อุณหภูมิ 37 °C ภายใต้บรรยากาศที่มี 5% CO2 in air เซลล์ไฟโบรบลาสจะเริ่มเจริญขึ้นมาจากชิ้นหนังหูในวันที่ 4–5 ของการเลี้ยง ทำการเปลี่ยนน้ำยาเลี้ยงเซลล์ทุกๆ 3 วัน จนเซลล์เจริญเต็มจานเลี้ยงเซลล์ จึงขยายการเลี้ยงให้มีปริมาณมากๆ แล้วนำเซลล์ที่ passage 3 มาแช่แข็งในน้ำยา αMEM + 20% FBS + 10% dimethyl sulfoxide (DMSO) แล้วจึงเก็บไว้ในไนโตรเจนเหลว ก่อนใช้จะนำเซลล์ที่แช่แข็งมาเลี้ยงในน้ำยา αMEM + 10% FBS เป็นเวลานาน 2-3 วัน แล้วจึงย่อยเซลล์ด้วย Trypsin /EDTA เพื่อให้เซลล์แยกออกจากกันเป็นเซลล์เดี่ยว เฉพาะ passage ที่ 4-6 เท่านั้นที่จะนำมาใช้เป็นเซลล์ต้นแบบ
2.1.2 วิธีการเตรียมไซโตพลาสซึมผู้รับ
เก็บรังไข่โคจากโรงฆ่าสัตว์โดยแช่ไว้ในน้ำเกลือขณะนำเข้าห้องปฏิบัติการ แล้วใช้เข็มขนาด18G ต่อกับกระบอกฉีดยาขนาด 10 ml ดูดไข่จากถุงไข่ที่มีเส้นผ่านศูนย์กลาง 3-8 มม. ทำการคัดเลือกไข่ที่มีชั้นเซลล์คิวมูลัสห่อหุ้มอย่างน้อย 2 ชั้น นำมาล้างในน้ำยา modified Dulbecco’s phosphate buffered saline (mDPBS) + 0.1% polyvinyl pyrolidone (PVP) ก่อนที่จะนำไปเลี้ยงในน้ำยาสำหรับเลี้ยงไข่ซึ่งปิดคลุมน้ำยาด้วย mineral oil เลี้ยงในสัดส่วน 20 ใบ/100 µl น้ำยาเลี้ยงไข่ประกอบด้วย TCM199 ที่เติมด้วย 10% FBS, 50 IU/ml human chorionic gonadotropin (hCG), 0.02 AU/ml follicle stimulating hormne (FSH) และ 1µg/ml 17β-estradiol นำไข่ไปเลี้ยงในตู้เพาะเลี้ยงที่อุณหภูมิ 38.5 °C ภายใต้บรรยากาศที่มี 5% CO2 in air เป็นเวลา 21 ชั่วโมง
2.1.3. การกำจัดนิวเคลียสออกจากไข่
หลังจากเลี้ยงไข่นาน 21 ชั่วโมง นำมาย่อยเซลล์คิวมูลัสออกด้วย 0.1% hyaluronidase แล้วคัดเลือกไข่ระยะ metaphase II (MII, มี first polar body) เพื่อนำไปกำจัดนิวเคลียสออกโดยใช้ micromanipulator ภายใต้กล้อง inverted microscope โดยบ่มไข่ในน้ำยา TCM199-HEPES + 10% FBS ที่มี 5 µg/ml cytochalasin B (CB) จากนั้นใช้ปิเปตแก้วปลายแหลมตัดเปลือกไข่บริเวณเหนือ first polar body จากนั้นใช้ปิเปตกดให้ first polar body และไซโตพลาสซึมที่อยู่ใต้ first polar body ออกมาประมาณ 10% ตรวจสอบผลสำเร็จการดูดนิวเคลียสด้วยการนำส่วนที่ดูดได้ไปย้อมด้วย 5 µg/ml Hoechst 33342 แล้วตรวจสอบภายใต้กล้องจุลทรรศน์ที่มีแสงอัลตราไวโอเลต
2.1.4. การฉีดเซลล์ต้นแบบและเชื่อมเซลล์
นำเฉพาะไข่ที่ดูดนิวเคลียสสำเร็จมาไว้ในน้ำยา TCM199-HEPES + 10% FBS แล้วฉีดเซลล์ต้นแบบ 1 เซลล์ (ขนาดเส้นผ่านศูนย์กลาง 14-16 µm) เข้าไปในบริเวณ perivitteline space จากนั้นทำการเชื่อมเซลล์ทั้งสองเข้าด้วยกัน โดยนำไข่ที่ฉีดเซลล์ต้นแบบแล้วครั้งละ 1 ใบ ไปไว้ระหว่างปลายสองข้างของ fusion electrode ในน้ำยา Zimmermann fusion medium เชื่อมเซลล์เข้าด้วยกันด้วยไฟฟ้ากระแสตรง (DC pulse) ที่จ่ายโดยเครื่องเชื่อมเซลล์ ความแรงไฟฟ้า 24 Volt นาน 15 µsec ทำ 2 ครั้ง ต่อเนื่องกัน แล้วนำไข่ไปล้างในน้ำยา TCM199-HEPES + 10% FBS แล้วพักไว้ 1 ชั่วโมง จึงตรวจการเชื่อมติดของไข่และเซลล์ต้นแบบ จากนั้นคัดเฉพาะเซลล์ที่เชื่อมติดกันไปกระตุ้นด้วย 7% ethanol เป็นเวลา 5 นาที ที่อุณหภูมิห้อง แล้วนำไปเลี้ยงในน้ำยาที่มี 1.25 µg/ml cytochalasin D (CD) และ 10 µg/ml cycloheximide (CHX) ในตู้เพาะเลี้ยงที่อุณหภูมิ 38.5 °C ภายใต้บรรยากาศ 5% CO2 in air เป็นเวลา 5 ชั่วโมง
2.1.5 การเลี้ยงตัวอ่อนในหลอดแก้ว
นำไข่ที่ผ่านการกระตุ้นแล้วมาเลี้ยงในน้ำยา CR1aa ในสัดส่วน 20 ใบ ต่อน้ำยา 100 µl ที่อุณหภูมิ 38.5 °C ภายใต้บรรยากาศที่มี 5% CO2, 5% O2, 90% N2 เป็นเวลา 4 วัน จะได้ตัวอ่อนเจริญถึงระยะ 32 เซลล์
2.2. การทำโคลนนิ่งซ้ำครั้งที่ 1 (Re-cloning 1)
การทำโคลนนิ่งซ้ำครั้งที่ 1 มีวิธีการทำคล้ายกันกับการทำ SCNT แต่จะใช้บลาสโตเมียร์ (เซลล์ตัวอ่อน) ของตัวอ่อนระยะ 32 เซลล์ มาใช้เป็นเซลล์ต้นแบบ แทนการใช้เซลล์ไฟโบรบลาส เริ่มโดยนำตัวอ่อนมาเจาะดูดบลาสโตเมียร์ออกมาไว้ในน้ำยา TCM199-HEPES + 10% FBS แล้วฉีดบลาสโตเมียร์ 1 เซลล์ เข้าไปในบริเวณ perivitteline space ของไข่ที่กำจัดนิวเคลียสออกแล้ว จากนั้นทำการเชื่อมเซลล์ทั้งสองเข้าด้วยกัน ด้วยไฟฟ้ากระแสตรง ที่จ่ายโดยเครื่องเชื่อมเซลล์ ความแรงไฟฟ้า 23 Volt นาน 17 µsec ทำ 2 ครั้ง ต่อเนื่องกัน แล้วนำไข่ไปล้างในน้ำยา TCM199-HEPES + 10% FBS แล้วพักไว้ 1 ชั่วโมง จึงตรวจการเชื่อมติดของไข่และเซลล์ต้นแบบ จากนั้นคัดเฉพาะเซลล์ที่เชื่อมติดกันไปกระตุ้น แล้วเลี้ยงในน้ำยา CR1aa นาน 4 วันจะได้ตัวอ่อนระยะ 32 เซลล์
2.3. การทำโคลนนิ่งซ้ำครั้งที่ 2 (Re-cloning 2)
การทำโคลนนิ่งซ้ำครั้งที่ 2 มีวิธีการทำเหมือนกันกับการทำโคลนนิ่งซ้ำครั้งที่ 1 โดยใช้บลาสโตเมียร์ ของตัวอ่อนระยะ 32 เซลล์ ที่ผลิตจากการทำโคลนนิ่งซ้ำครั้งที่ 1 มาใช้เป็นเซลล์ต้นแบบ แล้วทำตามขั้นตอนต่างๆเหมือนกับการทำโคลนนิ่งซ้ำครั้งที่ 1 แต่จะเลี้ยงตัวอ่อนนาน 7 วัน ซึ่งได้ตัวอ่อนเจริญถึงระยะบลาสโตซีส18.4% จากจำนวนตัวอ่อนที่นำเข้าเลี้ยงทั้งหมด


ภาพที่ 1 A การดูดบลาสโตเมียร์ออกจากตัวอ่อนระยะ 32 เซลล์ B บลาสโตเมียร์ที่ฉีดเข้าในไข่ที่กำจัดนิวเคลียสออกแล้ว C ตัวอ่อนระยะบลาสโตซีสจากการทำโคลนนิ่ง D และ E การย้อมตรวจจำนวนเซลล์ของตัวอ่อนระยะบลาสโตซีส สีแดงคือเซลล์โทรโฟบลาส สีน้ำเงินคือเซลล์ไอซีเอ็ม
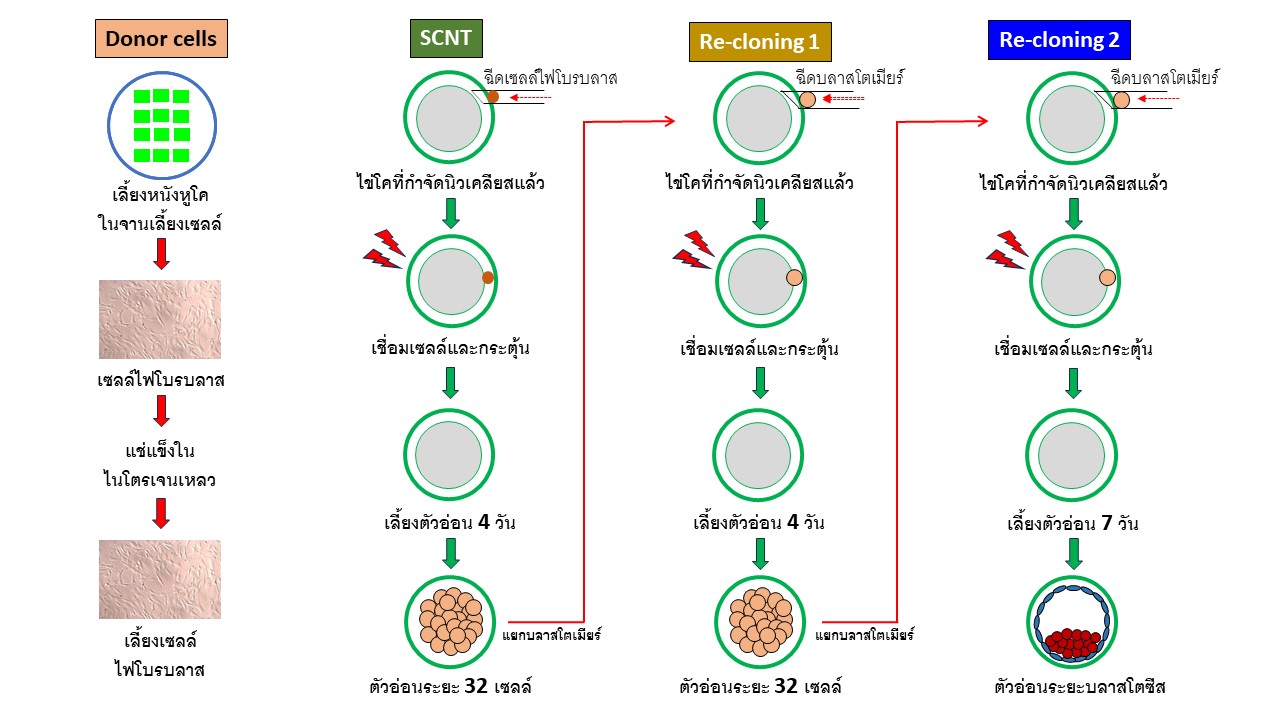
การทำโคลนนิ่งซ้ำครั้งที่ 1 และการทำโคลนนิ่งซ้ำครั้งที่ 2



